신성장 7대 유망 산업 (5) '바이오'
고부가가치 제약 산업으로 각광…한국은 바이오시밀러에 '눈독'
바이오시밀러, 효능은 같고 가격은 저렴
바이오 의약품은 사람 또는 기타 생물체에서 유래하는 세포·단백질·유전자 등을 원료로 제조한 의약품이다. 성분에 따라 생물학적 제제, 단백질 의약품, 항체 의약품, 세포 치료제 및 유전자 치료제 등으로 구분한다.
바이오 의약품은 화학물질을 합성해 만든 화학 의약품보다 분자량이 크고 구조가 복잡하다. 후보 물질 개발부터 임상 검증과 허가·생산·판매까지 최소 10년이 소요된다. 까다로운 생물 공정을 거치는 만큼 화학 의약품보다 가격이 비싸다. 반면 약효가 뛰어나고 부작용이 적은 장점이 있다.
바이오 의약품은 1909년 독일의 면역학자 파울 에를리히의 연구에서 비롯됐다. 그는 매독균만 선택적으로 배양할 수 있는 화학물질 배양에 성공했다. 이를 이용한 매독 치료제는 맞춤 치료제의 시초가 됐다.
1973년에는 스탠리 코헨 스탠퍼드대 교수와 허버트 보이어 UC샌프란시스코 교수가 유전자 재조합 DNA 기술인 ‘박테리아 플라스미드(plasmid)’의 합성에 성공했다. 이 기술의 핵심인 재조합 DNA는 특정 유전자를 DNA 운반체에 삽입해 만든 새로운 유전물질을 뜻한다. 유전자 재조합 의약품 생산의 길이 열리게 된 것이다.
1982년엔 일라이릴리가 인간 인슐린인 휴물린(Humulin)을 출시했고 이후 각종 바이오 신약이 잇달아 개발되면서 바이오 의약품이 의약 산업의 일부로 자리하게 됐다.
화학 의약품의 복제 의약품은 ‘제네릭’, 바이오 의약품의 복제 의약품은 ‘바이오시밀러’라고 통칭한다. 이 중 바이오시밀러는 오리지널 생물 의약품과 품질·비임상·임상시험에서 비교 동등성을 입증한 의약품으로 정의한다.
바이오시밀러는 생명체를 배양·분리하는 과정에서 미세한 차이가 발생한다. 동일한 공정을 거치더라도 단백질의 변형이 일어날 수 있기 때문에 오리지널 바이오 의약품과 같은 제품을 만드는 것 자체는 불가능하다. 오리지널 바이오 의약품의 제네릭을 바이오시밀러로 표현하는 이유가 여기에 있다.
그동안 국내 제약 업계는 특허 기간이 만료된 오리지널 화학 의약품의 제네릭 생산에 집중해 왔다. 하지만 최근 들어 분위기가 달라졌다. 1980년대 시장에 진입했던 1세대 바이오 의약품의 특허가 속속 만료되고 있기 때문이다. 주요 블록버스터 바이오 의약품은 2015년을 기점으로 유럽 특허 만료가 시작되며 2022년 안에 특허 보호 기간 대부분이 끝난다.
한국과학기술기획평가원이 2010년 펴낸 ‘바이오시밀러 기술과 정책 동향’에 따르면 바이오시밀러는 오리지널보다 개발 비용이 10분의 1 정도로 적게 소요된다. 개발 기간도 오리지널 대비 절반 정도 짧은 반면 개발 성공률은 10배 정도 높다.
소비자라고 할 수 있는 환자나 의사는 오리지널과 비슷한 효능에 가격이 저렴한 바이오시밀러를 선택할 수밖에 없다. 기업들이 바이오시밀러에 눈독을 들이는 이유다.
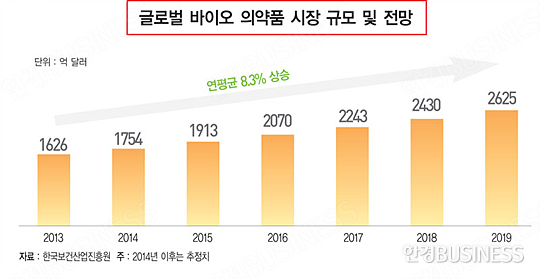
한국보건산업진흥원이 지난해 10월 발행한 ‘바이오시밀러 시장 동향 분석’에 따르면 글로벌 바이오 의약품의 시장 규모는 2013년 1626억 달러에서 연평균 8.3%씩 증가해 2019년 2625억 달러에 달할 것으로 전망된다.
이 가운데 바이오시밀러 시장만 놓고 보면 2013년 12억 달러에서 2019년 239억 달러에 이를 것으로 예상된다. 글로벌 바이오시밀러 시장의 국가별 점유율은 유럽이 44.0%로 가장 높고 이어 중국 13.2%, 미국 12.3%, 한국 8.0%, 인도 6.7%, 일본 3.0% 등의 순서다.
오리지널 의약품 개발에 주력해 온 글로벌 기업들도 바이오시밀러 사업에 눈독을 들이는 추세다. 미국의 다국적 제약사인 화이자는 지난해 바이오 의약품 회사인 ‘호스피라’를 사들였고 미국 왓슨도 스위스 제약 기업 ‘액타비스’를 인수하는 등 바이오시밀러 사업에 대한 투자를 늘리고 있다.
국내 바이오 시장에서는 셀트리온과 삼성바이오에피스가 성과를 내고 있다.
식품의약품안전처에 따르면 국내 기업이 개발한 바이오시밀러는 총 5개 품목이다. 2012년 셀트리온의 세계 최초 항체 바이오시밀러인 ‘램시마’가 국내에서 처음 허가됐고 2014년 셀트리온의 ‘허쥬마’와 한화케미칼의 ‘다빅트렐’이 개발됐다. 이후 2015년 삼성바이오에피스가 ‘브렌시스’와 ‘렌플렉시스’ 허가를 따냈다.
올해는 셀트리온 램시마의 성장세가 두드러질 전망이다. 램시마는 류마티스 관절염과 강직성 척추염, 궤양성 대장염, 건선 등에 효과를 발휘한다.
셀트리온은 램시마의 유럽 시장 누적 처방 환자 수가 6만 명을 돌파했다고 지난 2월 25일 밝혔다. 셀트리온에 따르면 지난해 램시마의 유럽 누적 처방 환자 수는 5만7992명으로 전년 대비 700% 이상 늘었다.
셀트리온은 2013년 8월 유럽 31개국에서 램시마 판매를 동시에 허가 받았다. 하지만 국가별 오리지널 의약품의 특허 만료 일자가 달라 15개 국가에서만 판매를 시작했다. 이후 지난해 2월 독일·프랑스·이탈리아·스페인·영국 등 유럽 주요 국가의 오리지널 의약품 특허 만료와 동시에 이들 국가에서의 판매가 이뤄지면서 처방 환자가 크게 늘었다는 게 회사 측의 설명이다.
셀트리온은 램시마가 유럽 오리지널 의약품 시장을 21% 이상 잠식한 것으로 추산하고 있다. 램시마 등 TNF-알파 억제제의 세계 시장 규모는 약 35조원 규모다. 이 중 유럽 주요 5개국의 시장 규모는 5조5000억원 수준이다.
셀트리온 관계자는 “램시마가 유럽 시장에서 기대 이상의 성장을 기록한 만큼 세계시장의 50%를 차지하는 미국에도 순조롭게 진입할 수 있을 것으로 예상한다”고 말했다. 램시마는 지난 2월 9일 미국 식품의약국(FDA) 자문위원회를 통해 판매 허가를 권고받았고 오는 4월 FDA의 판매 허가 승인을 앞두고 있다.
삼성바이오에피스가 개발한 브렌시스의 성과도 점차 가시화될 전망이다. 브렌시스는 류마티스 관절염, 건선성 관절염, 강직성 척추염, 축성 척추 관절염 및 건선 등을 치료한다.
브렌시스는 지난해 9월 식품의약품안전처로부터 바이오시밀러 품목 허가를 받은 후 12월 24일부터 국내에서 환자에게 처방되기 시작했다. 한 달 후에는 유럽에서 판매 허가를 받았다.
삼성바이오에피스는 자가면역질환 치료제 ‘베네팔리(국내명 브렌시스)’가 유럽연합집행위원회로부터 최종 허가를 받았다고 지난 1월17일 밝혔다. 베네팔리는 유럽연합(EU) 회원국 28개국과 유럽경제공동체(EEA) 3국에서 순차적으로 판매될 예정이다.
고한승 삼성바이오에피스 사장은 “2016년을 베네팔리의 유럽 허가로 시작했다”며 “올해는 삼성바이오에피스가 글로벌 바이오 제약사로 한 단계 도약하는 중요한 해가 될 것”이라고 말했다.
삼성바이오에피스에 따르면 오리지널 의약품인 엔브렐(성분명 에타너셉트)의 2014년 세계시장 규모는 89억 달러다. 유럽 시장 규모는 25억 달러 수준이다.
한경비즈니스=최은석 기자 choies@hankyung.com
시간 내서 보는 주간지 ‘한경비즈니스’ 구독신청 >>
© 매거진한경, 무단전재 및 재배포 금지
